Orang-Utans
| Orang-Utans | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Borneo-Orang-Utan (Pongo pygmaeus) im Nationalpark Tanjung Puting | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Unterfamilie | ||||||||||||
| Ponginae | ||||||||||||
| Elliot, 1912 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Pongo | ||||||||||||
| Lacépède, 1799 | ||||||||||||
| Arten | ||||||||||||
|
Die Orang-Utans (Pongo) sind eine Primatengattung aus der Familie der Menschenaffen (Hominidae). Von den anderen Menschenaffen unterscheiden sie sich durch ihr rotbraunes Fell und durch ihren stärker an eine baumbewohnende Lebensweise angepassten Körperbau. Sie leben auf den südostasiatischen Inseln Sumatra und Borneo; die Bestände beider Inseln werden heute als drei getrennte Arten geführt: Borneo-Orang-Utan (Pongo pygmaeus), Sumatra-Orang-Utan (Pongo abelii) und der Tapanuli-Orang-Utan (Pongo tapanuliensis).
Merkmale
[Bearbeiten | Quelltext bearbeiten]Allgemeines
[Bearbeiten | Quelltext bearbeiten]
Orang-Utans erreichen eine Kopf-Rumpf-Länge von 1,25 bis 1,5 Metern. Hinsichtlich des Gewichtes herrscht ein deutlicher Geschlechtsdimorphismus: Männchen sind mit 50 bis 90 Kilogramm nahezu doppelt so schwer wie Weibchen, die 30 bis 50 Kilogramm auf die Waage bringen. Tiere in Gefangenschaft neigen hingegen dazu, deutlich schwerer zu werden; Männchen können dabei ein Gewicht von nahezu 200 Kilogramm erreichen. Die Sumatra-Orang-Utans sind im Allgemeinen etwas leichter und zierlicher als ihre Verwandten auf Borneo. Das eher dünne und zottelig wirkende Fell der Orang-Utans ist dunkelrot oder rötlich braun gefärbt – bei den Tieren aus Sumatra meist etwas heller.
Die Gliedmaßen dieser Tiere zeigen starke Spezialisierungen an eine baumbewohnende Lebensweise. Die Arme sind sehr lang und kräftig und können eine Spannweite von 2,25 Metern erreichen. Die Hände sind hakenförmig und langgestreckt, der Daumen hingegen sehr kurz und nahe an der Handwurzel lokalisiert. Die vergleichsweise kurzen Beine sind sehr beweglich und nach innen einbiegbar, was dem senkrechten Klettern an Baumstämmen dient. Die Großzehe ist analog zum Daumen verkürzt und liegt relativ nah an der Fußwurzel, die übrigen Zehen sind hingegen verlängert und gebogen. Insgesamt erwecken die Füße dadurch einen handähnlichen Eindruck.
Kopf und Zähne
[Bearbeiten | Quelltext bearbeiten]
Der Kopf der Orang-Utans ist durch den hohen, gerundeten Schädel und die vorspringende, gewölbte Schnauze charakterisiert. Im Gegensatz zu den afrikanischen Menschenaffen sind die Überaugenwülste nur schwach ausgeprägt und die Augen sind klein und stehen eng beisammen. Die Schädel der Männchen sind allerdings wie die der Gorillas mit Sagittal- und Nuchalkämmen (Wülsten an der Oberseite des Kopfes und am Nacken) ausgestattet, die als Muskelansatzstellen dienen. Beide Geschlechter tragen einen Bart, wobei der der sumatranischen Art länger ist. Männliche Tiere sind überdies mit einem Kehlsack ausgestattet, der bei der borneanischen Art besonders groß ist. Erwachsene Männchen haben auffällige Wangenwülste, diese wachsen das ganze Leben und sind bei alten Tieren am deutlichsten ausgeprägt. Bei Borneo-Orang-Utans wachsen diese Wülste nach außen und sind nahezu unbehaart, bei Sumatra-Orang-Utans liegen sie flach am Kopf und sind mit weißen Haaren bedeckt.
Wie alle Altweltaffen haben Orang-Utans 32 Zähne, die Zahnformel lautet I2-C1-P2-M3. Die mittleren Schneidezähne sind groß, die äußeren hingegen stiftförmig und klein. Die Eckzähne der Männchen sind deutlich größer als die der Weibchen; die Backenzähne sind durch niedrige Zahnhöcker und eine stark gekräuselte Kaufläche charakterisiert, was eine Anpassung an die oft hartschalige Nahrung darstellt.
Verbreitung und Lebensraum
[Bearbeiten | Quelltext bearbeiten]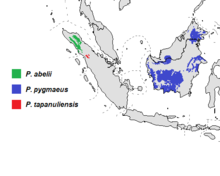
Noch vor einer Million Jahren kamen die Orang-Utans in ausgedehnten Gebieten Südostasiens vor. Ihr ursprüngliches Verbreitungsgebiet reichte vom südlichen China über Thailand, Vietnam bis nach Java, was durch Fossilienfunde in Südchina, Vietnam und der Insel Java belegt ist. In Teilen dieses Gebietes dürften sie zumindest bis vor wenigen tausend Jahren überlebt haben. Auf Java lebten sie noch in niederländischer Kolonialzeit, auf dem Festland noch in frühgeschichtlicher Zeit.
Orang-Utans kommen heute nur mehr auf den Inseln Borneo und Sumatra vor. Auf Sumatra bewohnen sie die nordwestlichen Regionen und Teile der Westküste, auf Borneo sind sie vorwiegend in den südlichen und östlichen Regionen anzutreffen.
Lebensraum der Orang-Utans sind tropische Regenwälder vom Meeresniveau bis in 1500 Metern über dem Meeresspiegel. Sie sind oft in Sumpfgebieten oder in der Nähe von Flüssen zu finden, einen weiteren bedeutenden Lebensraum stellen Flügelfruchtgewächs-Wälder dar.
Lebensweise
[Bearbeiten | Quelltext bearbeiten]Aktivitätszeiten und Fortbewegung
[Bearbeiten | Quelltext bearbeiten]
Wie alle Menschenaffen sind Orang-Utans tagaktiv. Sie haben zwei Aktivitätshöhepunkte, einmal am Vormittag und einmal am späten Nachmittag, in der Mittagszeit halten sie Rast. Zur Nachtruhe errichten sie sich ein Nest aus Ästen und Blättern.[1][2] Die Höhe bietet den Orang-Utans Schutz vor Raubtieren und Parasiten. In der Regel bauen sie jede Nacht ein neues Nest, gelegentlich wird dasselbe zweimal verwendet. Orang-Utans rollen sich zum Schlafen zusammen und sind im Vergleich zu anderen Primaten Langschläfer.[3] Für die Beobachtung von Orang-Utans ist das Zählen der Schlafnester eine wesentliche Methode der Bestandserhebung.[4]
Orang-Utans sind vorwiegend Baumbewohner. Dort bewegen sie sich hauptsächlich fort, indem sie langsam mit allen vier Gliedmaßen klettern oder auf den Ästen gehen – ihre Bewegungen sind aber gemächlicher als beispielsweise die der Gibbons. Insbesondere wenn sie es eilig haben, schwingen sie an den langen Armen (Brachiation). Um von einem Baum auf den anderen zu gelangen, können sie, um die Distanz zu verringern, diese in heftige Schaukelbewegungen versetzen.
Orang-Utans kommen selten auf den Boden. Oft geschieht dies nur, um von einem Baum zum nächsten zu kommen, wobei ihre Bewegungen vorsichtig und scheu sind. Erwachsene Männchen können hingegen manchmal sogar Streifzüge auf dem Boden unternehmen. Dieses Verhalten ist bei der borneanischen Art häufiger, vermutlich weil es dort im Gegensatz zu Sumatra keine Tiger gibt. Ihre Fortbewegung auf der Erdoberfläche ist ein vierfüßiges Gehen; im Gegensatz zu den afrikanischen Menschenaffen (Schimpansen und Gorillas) bewegen sie sich nicht im Knöchelgang fort, sondern stützen sich entweder auf die Fäuste oder auf die Innenkante der Hände.
Territorial- und Wanderverhalten
[Bearbeiten | Quelltext bearbeiten]
Orang-Utans haben mehrere Revierstrategien und können als „ansässige Tiere“, „Pendler“ und „Wanderer“ bezeichnet werden.[5]
„Ansässige Tiere“ bewohnen feste Territorien. Bei Weibchen umfassen diese rund 70 bis 900 Hektar und können sich mit den Revieren anderer Weibchen überschneiden. Die Territorien der Männchen sind mit 4000 bis 5000 Hektar deutlich größer und überlappen sich meist mit denen mehrerer Weibchen. Die Länge der täglichen Streifzüge hängt mit der Reviergröße zusammen; sie dienen aber nicht nur der Nahrungsaufnahme, sondern bei Männchen auch dem Kontakt mit den Weibchen oder der Suche nach etwaigen männlichen Konkurrenten.
Die Mehrzahl der männlichen Orang-Utans etabliert jedoch kein festes Territorium, sondern zieht als „Pendler“ oder „Wanderer“ umher. „Pendler“ halten sich nur für einige Wochen oder Monate in einem Gebiet auf und wechseln mehrmals im Jahr ihren Aufenthaltsort. Oft sind sie im darauffolgenden Jahr wieder in den gleichen Gebieten anzutreffen. Die Aufenthaltsorte der „Pendler“ können mehrere Kilometer auseinander liegen, die Streifzüge dieser Tiere sind dementsprechend deutlich länger als die der ansässigen Orang-Utans. Junge erwachsene Männchen sind meist „Wanderer“, sie sind nie lange in einem Gebiet anzutreffen, sondern ziehen beständig umher. Wenn sie älter werden, können sie manchmal ein festes Revier etablieren oder aber zeitlebens Wanderer bleiben.
Sozialverhalten
[Bearbeiten | Quelltext bearbeiten]
Orang-Utans sind in der Regel einzeln anzutreffen, dauerhafte Bindungen gibt es nur zwischen Weibchen und Jungtieren. Dennoch interagieren diese Tiere mit Artgenossen und führen keine strikt einzelgängerische Lebensweise; die Details dieser sozialen Beziehungen sind aber noch nicht restlos bekannt.
Begegnungen zwischen Männchen verlaufen meist feindselig. Durch Rufe machen sie auf sich aufmerksam, bei direkten Begegnungen kann es auch zu Handgreiflichkeiten kommen. Weibchen reagieren hingegen friedlicher aufeinander, manchmal gehen sie zu zweit für mehrere Tage gemeinsam auf Nahrungssuche. Generell sind Sumatra-Orang-Utans sozialer als Borneo-Orang-Utans, es gibt für diese Art Beobachtungen von größeren Gruppenbildungen und auch zeitweiligen Zusammenschlüssen eines Männchens mit einem Weibchen und deren Jungtieren.
Fix ansässige Tiere dürften einen höheren sozialen Rang als herumziehende haben, was unter anderem an den unterschiedlichen Fortpflanzungsstrategien deutlich wird. Niederrangigere, umherziehende Männchen erzwingen oft die Fortpflanzungen mit Weibchen. Opfer dieser erzwungenen Kopulationen, manchmal anthropomorph als „Vergewaltigung“ bezeichnet, werden ihrerseits zumeist junge oder rangniedrige Weibchen. Ansässige Männchen hingegen überwachen bei ihren Streifzügen die in ihrem Revier lebenden Weibchen, um sie vor erzwungenen Kopulationen zu schützen. Aufgrund des höheren Ranges dieser Männchen dürften die Weibchen der Paarung zustimmen.[6]
Kommunikation
[Bearbeiten | Quelltext bearbeiten]Orang-Utans sind ruhiger als andere Menschenaffen. Auffälligere Laute sind die lauten Schreie der Männchen. Diese dienen dazu, andere Männchen auf ihr Revier hinzuweisen und den Kontakt zu Weibchen herzustellen. Bedingt durch den größeren Kehlsack sind die Schreie der Borneo-Orang-Utans lauter und langgezogener als die der Sumatra-Orang-Utans. Über andere lautliche Äußerungen oder Kommunikationen mittels Mimik und Körperhaltungen ist wenig bekannt.
Werkzeuggebrauch
[Bearbeiten | Quelltext bearbeiten]
Der Gebrauch von Werkzeugen kommt bei Orang-Utans in freier Wildbahn seltener vor als beispielsweise bei Schimpansen. Man hat aber Tiere dabei beobachtet, wie sie Holzstöcke dazu verwendet haben, um damit zu graben, zu kämpfen oder sich zu kratzen. Um an die schmackhaften Samen von Neesia-Früchten zu gelangen, die in eine Fruchtschale mit stechenden Haaren eingebettet sind, stellen Orang-Utans aus dünnen Zweigen passende Holzstäbchen her. Vor Regen und praller Sonne schützen sie sich mit großen Blättern, die sie über ihren Kopf halten.
Der vergleichsweise geringe Werkzeuggebrauch könnte auch an der eher einzelgängerischen Lebensweise dieser Tiere liegen, was die Bedingungen für die Weitergabe erworbenen Verhaltens erschwert. Das stimmt auch mit Beobachtungen überein, wonach der Werkzeuggebrauch bei den sozialeren Sumatra-Orang-Utans weitaus häufiger ist als bei den Borneo-Orang-Utans.[6]
Mit früher im Zoologischen Garten Osnabrück in Gefangenschaft lebenden Sumatra-Orang-Utans konnte bei Laborstudien gezeigt werden, dass die Tiere nicht nur in der Lage sind, Werkzeuge zu nutzen, sondern auch einfache Werkzeuge herzustellen (z. B. das Zusammenstecken von Metallstäben), um dadurch an ein Ziel wie Futter zu gelangen.[7][8] Weitere Zoostudien haben gezeigt, dass Orang-Utans spontan und ohne Vormachen Hammerwerkzeuge nutzen, um Nüsse aufzuknacken – ein Verhalten, das (bisher) in der Wildnis bei Orang-Utans nicht nachgewiesen wurde.[9]
Im Jahr 2022 wurde ein in freier Wildbahn lebender Sumatra-Orang-Utan dabei beobachtet, wie er eine Wunde, die er bei einem Kampf mit einem anderen Artgenossen erlitten hatte, mit einer Heilpflanze behandelte.[10]
Natürliche Feinde
[Bearbeiten | Quelltext bearbeiten]Der bedeutendste natürliche Feind der Sumatra-Orang-Utans ist der Sumatra-Tiger. Der auf Sumatra und Borneo lebende Sunda-Nebelparder wird heranwachsenden Tieren und Weibchen gefährlich, kann aber ausgewachsene Männchen in der Regel nicht erlegen. Weitere Bedrohungen stellen manchmal Krokodile und verwilderte Haushunde dar.
Ernährung
[Bearbeiten | Quelltext bearbeiten]
Orang-Utans sind hauptsächlich Pflanzenfresser. Mit rund 60 % stellen Früchte den größten Bestandteil ihrer Nahrung dar, dabei nehmen sie oft Früchte mit harten Schalen oder Samen zu sich. Außerdem verzehren sie auch Blätter, junge Triebe und Rinde. Tierische Nahrung spielt nur eine untergeordnete Rolle. Gelegentlich verzehren sie aber Insekten, Vogeleier und kleine Wirbeltiere, so schütteln sie Plumploris aus den Bäumen und verspeisen die durch den Sturz betäubten Tiere.[11] Die sumatrische Art scheint einen etwas größeren tierischen Anteil in ihrer Nahrung zu haben als die Borneos. Durch die Verbreitung der Samen der gegessenen Früchte spielen die Tiere eine Rolle für die Vermehrung mancher Pflanzen.[12]
Bei der Nahrungsaufnahme sitzen sie entweder oder hängen an den Ästen, wobei ihr Körpergewicht diese nach unten biegt, was es ihnen erleichtert, an Früchte oder Blätter zu gelangen. Ihre kräftigen Arme erlauben es ihnen, auch dickere fruchttragende Äste umzubiegen oder manchmal sogar abzubrechen.
Während der alle 2 bis 10 Jahre vorkommenden Mastjahre in Dipterocarpaceen-Wäldern können sie weit mehr Nahrung als üblich zu sich nehmen. Sie wird als Fettvorrat für Zeiten des Nahrungsmangels angelegt. Diese Veranlagung dürfte ein Grund dafür sein, warum Orang-Utans in Gefangenschaft zur Verfettung neigen.
Fortpflanzung und Entwicklung
[Bearbeiten | Quelltext bearbeiten]

Paarung und Geburt
[Bearbeiten | Quelltext bearbeiten]Orang-Utans haben keine feste Paarungszeit, die Fortpflanzung kann das ganze Jahr über erfolgen. Allerdings kann sie vom Nahrungsangebot abhängen, sodass mehrere Weibchen einer Region ihre Jungen nahezu gleichzeitig zur Welt bringen. Die Länge des Sexualzyklus beträgt rund 28 Tage, der Östrus dauert rund 5 bis 6 Tage, die Weibchen zeigen keine Regelschwellung.
Wie oben erwähnt, gibt es zwei Fortpflanzungsstrategien, die erzwungene Kopulation durch umherziehende Männchen und die freiwillige Paarung mit ansässigen Männchen. In einer Untersuchung sorgte jede der beiden Strategien für rund die Hälfte des Nachwuchses.[6] Nach einer rund acht- bis neunmonatigen Tragzeit (durchschnittlich 245 Tage) bringt das Weibchen in der Regel ein einzelnes Jungtier zur Welt, Zwillinge sind selten. Neugeborene wiegen rund 1,5 bis 2 Kilogramm. Das Geburtsintervall beträgt sieben bis acht Jahre und ist somit das längste aller Menschenaffen.[13]
Entwicklung der Jungtiere
[Bearbeiten | Quelltext bearbeiten]Die Aufzucht der Jungtiere obliegt allein dem Weibchen, das Männchen beteiligt sich nicht daran. In den ersten Lebensmonaten klammert sich das Neugeborene am Bauch der Mutter fest und bis zum Alter von zwei Jahren wird es bei den Streifzügen getragen, von ihr mit Nahrung versorgt und schläft im gleichen Nest. Im Altersabschnitt von zwei bis fünf Jahren beginnt das Jungtier seine Kletterfähigkeiten zu entwickeln, es beginnt seine Umgebung zu erkunden, ohne allerdings den Sichtkontakt zu verlieren, und es lernt den Nestbau. Im gleichen Zeitraum – mit rund 7 Jahren – wird es entwöhnt.[14]
Im Alter von fünf bis acht Jahren setzt die zunehmende Trennung von der Mutter ein. Zwar haben die Jungen noch häufigen Kontakt mit der Mutter, suchen aber in dieser Phase häufig den Kontakt zu Gleichaltrigen und bilden mit ihnen Zusammenschlüsse. In dieser Zeit kann es dazu kommen, dass ein Weibchen zwei Kinder um sich hat, ein heranwachsendes und ein neugeborenes.
Geschlechtsreife und Lebenserwartung
[Bearbeiten | Quelltext bearbeiten]Weibchen erreichen die Geschlechtsreife mit rund sieben Jahren, bei Männchen dürfte das variabler sein und mit acht bis 15 Jahren eintreten. Nach der endgültigen Trennung von der Mutter versuchen die Weibchen, ein eigenes Territorium zu etablieren, oft nahe dem Revier der Mutter. Es dauert allerdings noch einige Jahre, bevor sie sich das erste Mal fortpflanzen, meist erst ab dem 14. Lebensjahr.[15]
Männchen durchleben nach dem Eintreten der Geschlechtsreife meist eine längere Periode als „Wanderer“. In dieser Zeit sind sie zwar zeugungsfähig (und erzwingen Kopulationen), unterscheiden sich aber äußerlich noch kaum von Weibchen. Die typischen sekundären Geschlechtsmerkmale wie Wangenwülste und Kehlsäcke erscheinen erst viel später, ungefähr zwischen dem 15. und 20. Lebensjahr. Das Auftreten dieser Merkmale hängt oft mit der Etablierung eines eigenen Reviers oder mit der Abwesenheit anderer Männchen zusammen. Gelingt es ihnen, ein eigenes Territorium zu errichten, bilden sich diese Merkmale schnell, oft innerhalb weniger Monate.
Weibchen bringen aufgrund ihrer geringen Fortpflanzungsrate oft nur zwei bis drei Jungtiere in ihrem Leben zur Welt, die Menopause bei Tieren in Gefangenschaft tritt mit rund 48 Jahren ein. Die Lebenserwartung in freier Wildbahn wird auf bis zu 50 Jahre geschätzt. Tiere in menschlicher Obhut werden älter und können ein Alter von 60 Jahren erreichen.
Systematik
[Bearbeiten | Quelltext bearbeiten]Äußere Systematik
[Bearbeiten | Quelltext bearbeiten]
Orang-Utans bilden zusammen mit den Gorillas, den Schimpansen (Gemeiner Schimpanse und Bonobo) sowie dem Menschen die Familie der Menschenaffen (Hominidae). Orang-Utans bilden dabei die Schwestergruppe der übrigen Arten und werden in einer eigenen Unterfamilie, Ponginae, geführt, die den Homininae gegenübersteht. Das wird auch geographisch deutlich, da die übrigen Menschenaffen in Afrika leben beziehungsweise von dort stammen. Das kommt im Kladogramm (rechts) zum Ausdruck.
Es gibt einige ausgestorbene Primaten, die heute in den Formenkreis des Tribus Pongini gestellt und somit als Verwandte der Orang-Utan-Vorfahren interpretiert werden. Hierzu gehören unter anderem Sivapithecus / Ramapithecus, Khoratpithecus, Ankarapithecus, Lufengpithecus sowie vermutlich auch Meganthropus und Gigantopithecus.[16]
Innere Systematik
[Bearbeiten | Quelltext bearbeiten]Traditionell wurden beide auf getrennten Inseln lebende Populationen als Unterarten einer gemeinsamen Art betrachtet. Genetische Untersuchungen Ende des 20. Jahrhunderts sprachen aber für eine Aufteilung in zwei Arten,[17] was in der Abspaltung des Sumatra-Orang-Utan (Pongo abelii) vom Borneo-Orang-Utan (Pongo pygmaeus) im Jahr 2001 resultierte. Beide sind heute als eigenständige Arten anerkannt.[18] Diese Aufteilung kann heute neben den genetischen Daten auch mit Unterschieden im Körperbau und der Lebensweise begründet werden. Die borneanische Art wird in zwei oder drei Unterarten, Pongo pygmaeus pygmaeus, Pongo pygmaeus wurmbii und manchmal zusätzlich Pongo pygmaeus morio unterteilt,[18] die sich hinsichtlich des Schädelbaus unterscheiden. Weitere genetische Untersuchungen an den Orang-Utans von Sumatra konnten diese aber nicht als monophyletische Gruppe darstellen, da eine Population südlich des Tobasees näher mit dem Borneo-Orang-Utan verwandt ist.[19][20] Dies führte im Jahr 2017 zur Beschreibung des Tapanuli-Orang-Utans (Pongo tapanuliensis).[21]
Die ausgestorbenen Orang-Utans aus verschiedenen Regionen Südostasiens, die zum Teil deutlich größer waren als die heutigen Tiere, wurden als verschiedene Arten beschrieben, etwa Pongo palaeosumatrensis (Sumatra), Pongo devosi und Pongo weidenreichi (südliches China und Vietnam)[22] und Pongo hooijeri (ebenfalls Vietnam). Ihr taxonomischer Status und ihr Verhältnis zu den heutigen Arten ist umstritten.
Im Januar 2011 gab ein Team von Wissenschaftlern bekannt, dass das komplette Genom des Orang-Utans sequenziert worden sei.[23]
Stammesgeschichte
[Bearbeiten | Quelltext bearbeiten]Die Entwicklung der Gattung Orang-Utan (Pongo) erfolgte in Asien[24] (während sich Homo primär in Afrika entwickelte). Nach molekulargenetischen Untersuchungen spaltete sich zuerst der Sumatra-Orang-Utan (Pongo abelii) von der Linie der ursprünglichen Orang-Utans ab; dies erfolgte im Pliozän vor rund 3,4 Millionen Jahren. Er ist heute nördlich des Tobasees auf Sumatra verbreitet. Die zweite Linie umfasst den Tapanuli-Orang-Utan (Pongo tapanuliensis), der südlich des Tobasees vorkommt, und den Borneo-Orang-Utan (Pongo pygmaeus) von der Insel Borneo. Beide trennten sich erst im Mittelpleistozän vor 674.000 Jahren voneinander ab.[21]
Aufgrund fortschreitender Trockenheit, wiederkehrender Vergletscherungen und Veränderung der Monsunaktivität verschob sich der Lebensraum des tropischen Regenwaldes auf dem asiatischen Kontinent seit dem späten Miozän und im Pleistozän in Richtung Äquator.[25][26] Im Pleistozän war die Gattung noch vor etwa 60.000 Jahren auch in Malaysia,[27] vor 40.000 Jahren noch im Raum Südchina bis Java verbreitet.[28][29] Die Folgen des klimabedingten Rückzuges sind noch heute an den genetischen Verteilungsmustern des Borneo-Orang-Utan (Pongo pygmaeus) auf dem pleistozänen Refugium Sumatra-Borneo ablesbar.[30] Allerdings wird die Auffassung vom Refugialraum Borneo in Frage gestellt.[31]
Orang-Utans und Menschen
[Bearbeiten | Quelltext bearbeiten]Benennung
[Bearbeiten | Quelltext bearbeiten]

Die Bezeichnung „Orang-Utan“ stammt von den malaiischen Wörtern „orang“ (Mensch) und „utan“ oder „hutan“ (Wald) und bedeutet demzufolge „Waldmensch“. In europäischen Sprachen erschien dieser Name erstmals 1631.[32] Laut Brehms Tierleben behaupten „die Javaner […], dass die Affen wohl reden könnten, wenn sie nur wollten, es jedoch nicht täten, weil sie fürchteten, arbeiten zu müssen.“[33] In lokalen Sprachen der Region sind auch die Bezeichnungen maias oder mawas gebräuchlich.
Die Orang-Utans Sumatras wurden im 19. Jahrhundert zunächst als eigene Art beschrieben, später setzte sich die bis zum Ende des 20. Jahrhunderts gültige Systematik durch, die die Populationen beider Inseln als Unterarten einer gemeinsamen Art betrachtete. Die Unterschiede im Körperbau und im Verhalten, kombiniert mit molekularen Studien, führten dazu, dass sie heute als zwei getrennte Arten geführt werden.
Die wissenschaftliche Bezeichnung der Gattung Pongo geht auf den englischen Seefahrer Andrew Battell (um 1565–1614) zurück.[34] In seinem „Bericht über Angola und die angrenzenden Regionen“ (1613)[35] beschrieb er zwei „Monster“ (vermutlich Gorilla und Schimpanse), deren größeres die Einheimischen „Pongo“ und deren kleineres sie „Engeco“ nannten.
Battells Reisebeschreibung wurde häufig zitiert und vielfach nachgedruckt,[36] mit der Folge, dass Pongo (vergl.: M’Pungu) Jahrzehnte lang als übergeordnete Bezeichnung für alle damals von Europäern entdeckten großen Menschenaffen verwendet wurde. So heißt es beispielsweise noch 1802 bei Immanuel Kant in dessen Physischer Geographie:
- „Der Orang-Utan, der Waldmensch, davon die größten in Afrika Pongos genannt werden. Sie sind in Kongo, ingleichen in Java, Borneo und Sumatra anzutreffen, gehen immer aufrecht und sind sechs Schuh hoch. […] Es giebt noch eine kleinere Gattung, welche die Engländer Schimpanse nennen […].“[37]
Ähnlich art-übergreifend formulierte es 1819 Arthur Schopenhauer, als er sich über die Intelligenz der Menschenaffen Gedanken macht:
- „Es ist allmälig gewiß geworden, dass der so höchst intelligente Orang-Utan ein junger Pongo ist, welcher, wann herangewachsen, die große Menschenähnlichkeit des Antlitzes und zugleich die erstaunliche Intelligenz verliert […] und an ihrer Stelle eine außerordentliche Muskelkraft sich entwickelt, welche, als zu seiner Erhaltung ausreichend, die große Intelligenz jetzt überflüssig macht.“[38]
Andererseits bezeichnete Jean-Baptiste de Lamarck 1809 umgekehrt die afrikanischen Schimpansen und die asiatischen großen Menschaffen als Orangs:
- „Der Orang von Angola (Simia troglodytes, Lin.) ist das vollkommenste aller Tiere: es ist vollkommener als der indische Orang (Simia satyrus, L.), den man Orang-Utang genannt hat.“[39]
Die nomenklatorische Verwirrung innerhalb der Menschenaffen wurde erst im Laufe des 19. Jahrhunderts bereinigt; sie ist vor allem darauf zurückzuführen, dass zuvor kaum einer der frühen europäischen Naturforscher einen lebenden Menschenaffen zu Gesicht bekommen hatte und kein einziger Vergleiche an lebenden Exemplaren von Orang-Utans, Gorillas und Schimpansen hatte vornehmen können.
Der Orang-Utan war Pate bei der Vergabe des Trivialnamens der mit orange-braunroten „Haaren“ versehenen Krabbe Achaeus japonicus, die in mehreren europäischen Sprachen als Orang-Utan-Krabbe bezeichnet wird.
Erforschung
[Bearbeiten | Quelltext bearbeiten]Erst ab der zweiten Hälfte des 20. Jahrhunderts wurde mit Feldstudien begonnen, um das Verhalten dieser Tiere in freier Wildbahn zu untersuchen. Bekannteste Forscherin in diesem Kontext ist Birutė Galdikas.
Wie bei den anderen Menschenaffen werden auch bei Orang-Utans Laboruntersuchungen durchgeführt, um die Intelligenz und die Kommunikationsfähigkeit dieser Tiere zu erforschen. Bekannt wurde hier der Orang-Utan Chantek im Zoo von Atlanta (US-Staat Georgia). Im Gegensatz zur freien Natur, wo nur selten Werkzeuggebrauch vorkommt, lässt sich bei Tieren in Gefangenschaft häufig die Verwendung von Werkzeugen beobachten.[40] Sie schaffen es auch, knifflige Problemstellungen zu lösen, etwa eine mit Schnallen verschlossene Schachtel zu öffnen, in der sich eine reife Frucht befindet.[41] Ihre Intelligenz, Geschicklichkeit und Kraft befähigt sie außerdem dazu, nachlässig konstruierte Sicherheitsmechanismen in Zoos zu überwinden und aus Gehegen auszubrechen.[42]
Im Rahmen der Erforschung der Kommunikationsfähigkeit wurde Orang-Utans beigebracht, mit Hilfe einer Symbolsprache zu kommunizieren.[43]
Für die in europäischen Zoos lebenden Orang-Utans wird seit 1982 ein Orang-Utan-Zuchtbuch geführt, seit 2021 von Simone Schehka, der Direktorin des Allwetterzoos in Münster.[44]
Bedrohung
[Bearbeiten | Quelltext bearbeiten]Gefährdende Faktoren
[Bearbeiten | Quelltext bearbeiten]
Das Verbreitungsgebiet der Orang-Utans ist seit dem Pleistozän stark zurückgegangen. Heute sind alle drei Arten stark bedroht. Die Gründe dafür liegen in erster Linie in der Zerstörung ihres Lebensraumes, daneben in der Bejagung und im Handel – insbesondere mit Jungtieren. Verschärft werden diese Faktoren durch die langsame Reproduktionsrate der Tiere.
Hauptbedrohung stellt heute die Zerstörung ihres Lebensraumes dar. In großem Ausmaß werden Wälder gerodet, einerseits zur Holzgewinnung, andererseits zur Errichtung landwirtschaftlich genutzter Flächen. Neuerdings gefährdet die starke Nachfrage nach Palmöl zunehmend die Habitate der Orang-Utans. Malaysia und Indonesien, die beiden Länder, in denen Orang-Utans leben, zählen zu den Hauptproduzenten dieses Produktes.
Die Bejagung stellt einen weiteren Faktor dar. In manchen Gegenden – etwa im Inneren Borneos – wird ihr Fleisch gegessen. Darüber hinaus werden sie mancherorts gezielt verfolgt, wenn sie auf der Nahrungssuche in Obstplantagen eindringen. Ihre Größe und ihre eher gemächlichen Bewegungen machen sie zu einem leichten Ziel für Jäger. Hinzu kommt, dass Jungtiere gefangen und als Haustiere verkauft werden, was meist mit der Tötung der Mutter einhergeht. In den 1990er Jahren wurden Orang-Utans nach Taiwan geschmuggelt, vielleicht unter Einfluss einer Fernsehshow, in der ein Orang-Utan als „ideales Haustier“ auftrat. Einer Schätzung aus dem Jahr 2002 zufolge werden wöchentlich zwei Tiere aus Borneo herausgeschmuggelt.[45] Da Orang-Utans im Washingtoner Artenschutzübereinkommen (CITES) gelistet sind, sind solche Praktiken illegal.
Darüber hinaus sind diese Tiere durch die Übertragung von Krankheiten gefährdet. Durch ihre enge Verwandtschaft mit dem Menschen können sie etwa an Hepatitis, Cholera, Malaria und Tuberkulose erkranken, die beispielsweise durch die zahlreichen Kontakte in Nationalparks mit Wildhütern und Touristen übertragen werden.
Schutzmaßnahmen
[Bearbeiten | Quelltext bearbeiten]

Sowohl auf Sumatra als auch im malaysischen und indonesischen Teil Borneos gibt es Schutzgebiete und Nationalparks für die bedrohte Fauna der Region. Es wurden auch einige Auswilderungsstationen gegründet, in denen beschlagnahmte Jungtiere wieder auf ein Leben in freier Wildbahn vorbereitet werden sollen.
Auf Sumatra kommen wildlebende Orang-Utans nur noch in den Wäldern der beiden nördlichen Provinzen Aceh und Nordsumatra vor, viele davon im Nationalpark Gunung Leuser. Orang-Utans stehen seit mehr als 60 Jahren unter Schutz. Das indonesische Gesetz verbietet es, sie zu töten, zu fangen, zu halten oder mit ihnen zu handeln. Trotzdem landen jedes Jahr zahlreiche Tiere auf dem Schwarzmarkt und in Privathaushalten.
Die Stiftung PanEco[46] setzt sich mit dem Sumatra Orang-Utan Schutzprogramm SOCP[47] seit 1999 für das Überleben der Orang-Utans auf Sumatra ein. Zusammen mit der indonesischen Naturschutzbehörde PHKA, der Stiftung Yayasan Ekosistem Lestari YEL (Stiftung für ein nachhaltiges Ökosystem) und der Zoologischen Gesellschaft Frankfurt werden illegal in Gefangenschaft gehaltene Orang-Utans konfisziert und wieder in ihren natürlichen Lebensraum ausgewildert. Eine Auswilderungsstation befindet sich im Nationalpark Bukit Tigapuluh in der Provinz Jambi. Hier gibt es seit dem 19. Jahrhundert keine Orang-Utans mehr, obwohl der Wald als Lebensraum für diese Tiere geeignet ist. Die Wiederansiedlung ist hier möglich, denn laut IUCN-Richtlinien dürfen keine Tiere in Gebieten freigelassen werden, in denen noch wildlebende Populationen vorkommen. Aus diesem Grunde musste das in den 1970er Jahren gegründete Rehabilitationszentrum Bohorok in Nordsumatra geschlossen werden, welches drei Jahrzehnte lang konfiszierte Orang-Utans in den Nationalpark Gunung Leuser auswilderte. Anfang 2011 konnte die Stiftung PanEco eine zweite Auswilderungsstation im Naturreservat Jantho in der nördlichsten Provinz Aceh eröffnen. Hier werden alle in Aceh konfiszierten Tiere wieder ausgewildert.[48] Neben der Wiederansiedlung von Orang-Utans gehören auch das Monitoring von Orang-Utan-Populationen, die Erforschung des Verhaltens wildlebender Orang-Utans, Umweltbildung und Öffentlichkeitsarbeit zu den Kernaufgaben der Stiftung PanEco auf Sumatra. Ihr Hauptziel ist, den tropischen Regenwald zu schützen und zu erhalten.
Auf Borneo unterhält die Borneo Orangutan Survival Foundation (BOS) zwei Rehabilitationsprojekte, beide im indonesischen Teil der Insel: Nyaru Menteng sowie Samboja Lestari.[49] Neben anderen werden diese Projekte in Zusammenarbeit mit der indonesischen BOS Foundation auch von Borneo Orangutan Survival Deutschland, BOS Schweiz und weiteren Organisationen gefördert.[50]
Weitere Schutzgebiete befinden sich unter anderem im Nationalpark Gunung Palung, im Nationalpark Tanjung Puting und im Nationalpark Kutai. Der größtenteils zu Malaysia gehörige Norden Borneos führt zwei Aufzuchts- und Auswilderungszentren: das Sepilok Orangutan Rehabilitation Centre bei Sandakan im Bundesstaat Sabah sowie das kleinere, außerhalb Kuchings gelegene Semenggoh-Reservat in Sarawak.[51] Ein weiteres wichtiges Schutzgebiet für Borneo-Orang-Utans in Malaysia ist das Danum-Tal, das ebenfalls in Sabah liegt. In den 1990er-Jahren wurden von der Borneo Orangutan Survival Foundation 350 Orang-Utans in das Schutzgebiet des Meratus ausgewildert. Dort betreibt die ALT Foundation mit Unterstützung der Borneo Orang-Utan-Hilfe[52] ein gemeinsames Schutzprojekt.
Ein Austausch findet zudem zwischen Sarawak und der Malaiischen Halbinsel statt: auf der Aufzuchts- und Auswilderungsinsel Pulau Orang Utan, Teil der bei Taiping (Perak) gelegenen Erholungsanlage Bukit Merah.[53]
Bestandszahlen und Gefährdungsgrad
[Bearbeiten | Quelltext bearbeiten]Schätzungen über die Gesamtpopulation der Orang-Utans sind schwierig. Transekt-Untersuchungen auf Sumatra im Jahre 2015 ergaben als Hochrechnung eine Population von 13.846 Sumatra-Orang-Utans, deutlich mehr als in alten Schätzungen.[54] Bei den Borneo-Orang-Utans wird die Population auf 104.700 geschätzt.[55] Von den Tapanuli-Orang-Utans gibt es einzig noch 800 Exemplare.[56]
Die IUCN listet sowohl die beiden Arten auf Sumatra wie auch die Art auf Borneo als „vom Aussterben bedroht“ (critically endangered).[57]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Thomas Geissmann: Vergleichende Primatologie. Springer, Berlin 2003, ISBN 3-540-43645-6.
- Ronald M. Nowak: Walker’s mammals of the world. 6. Auflage. Johns Hopkins University Press, Baltimore 1999, ISBN 0-8018-5789-9 (englisch).
- D. E. Wilson & D. M. Reeder: Mammal Species of the World. Johns Hopkins University Press, 2005, ISBN 0-8018-8221-4 (englisch).
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Adam van Casteren, William I. Sellers, Susannah K. S. Thorpe, Sam Coward, Robin H. Crompton, Julia P. Myatt & A. Roland Ennos: Nest-building orangutans demonstrate engineering know-how to produce safe, comfortable beds. In: Proceedings of the National Academy of Sciences. 16. April 2012, doi:10.1073/pnas.1200902109
- ↑ Haarige Bettenbauer: Orang-Utans schlummern in Komfortnestern. In: Spiegel Online. 17. April 2012
- ↑ BOS Schweiz: Geheimnisvolle Nester im Regenwald. Abgerufen am 2. Juni 2019.
- ↑ BOS Deutschland: Bettensuche. Abgerufen am 1. Februar 2020.
- ↑ Bezeichnungen nach Geissmann, 2003, S. 292–293
- ↑ a b c K. A. Cawthon Lang: Primate Factsheets: Orangutan (Pongo) Behavior. (Zugriff am 9. Dezember 2009)
- ↑ Lethmate, Jürgen.: Problemlöseverhalten von Orang-Utans (Pongo pygmaeus). 1. Auflage. Parey, Berlin 1977, ISBN 3-489-71436-9.
- ↑ Jürgen Lethmate: Tool-using skills of orang-utans. In: Journal of Human Evolution. Band 11, Nr. 1, Januar 1982, ISSN 0047-2484, S. 49–64, doi:10.1016/s0047-2484(82)80031-6 (elsevier.com [abgerufen am 25. November 2018]).
- ↑ Bandini, Elisa; Grossmann, Johannes; Funk, Martina; Albiach-Serrano, Anna; Tennie, Claudio.: Naïve orangutans (Pongo abelii and Pongo pygmaeus) individually acquire nut-cracking using hammer tools. 2021, doi:10.1002/ajp.23304.
- ↑ Isabelle B. Laumer, Arif Rahman, Tri Rahmaeti, Ulil Azhari, Hermansyah, Sri Suci Utami Atmoko, Caroline Schuppli: Active self-treatment of a facial wound with a biologically active plant by a male Sumatran orangutan - Scientific Reports. In: Scientific Reports. Band 14, Nr. 1, 2. Mai 2024, ISSN 2045-2322, S. 8932, doi:10.1038/s41598-024-58988-7 (nature.com [abgerufen am 3. Mai 2024]).
- ↑ MVS Import: Fleischeslust im Dschungel. In: wissenschaft.de. 18. Januar 2012, abgerufen am 6. März 2024. nach doi:10.1007/s10764-011-9574-z
- ↑ BOS Schweiz: Orang-Utan auf Wanderschaft. BOS Schweiz, abgerufen am 2. Juni 2019.
- ↑ Maria van Noordwijk: Die langsamen Menschenaffen - ein Interview mit Dr. Maria van Noordwijk. BOS Schweiz, abgerufen am 2. Juni 2019.
- ↑ Maria van Noordwijk: Die langsamen Menschenaffen - ein Interview mit Dr. Maria van Noordwijk. BOS Schweiz, abgerufen am 2. Juni 2019.
- ↑ Maria van Noordwijk: Die langsamen Menschenaffen - ein Interview mit Dr. Maria van Noordwijk. BOS Schweiz, abgerufen am 2. Juni 2019.
- ↑ Bernard Wood, Terry Harrison: The evolutionary context of the first hominins. In: Nature, Band 470, 2011, S. 347–352, doi:10.1038/nature09709
- ↑ XiuFeng Xu, Úlfur Árnason: The mitochondrial DNA molecule of sumatran orangutan and a molecular proposal for two (Bornean and Sumatran) species of orangutan. In: Journal of Molecular Evolution. 43, 1996, S. 431–437
- ↑ a b Don E. Wilson & DeeAnn M. Reeder (Hrsg.): Pongo ( vom 13. April 2013 im Internet Archive) in Mammal Species of the World. A Taxonomic and Geographic Reference (3rd ed).
- ↑ Alexander Nater, Pirmin Nietlisbach, Natasha Arora, Carel P. van Schaik, Maria A. van Noordwijk, Erik P. Willems, Ian Singleton, Serge A. Wich, Benoit Goossens, Kristin S. Warren, Ernst J. Verschoor, Dyah Perwitasari-Farajallah, Joko Pamungkas und Michael Krützen: Sex-Biased Dispersal and Volcanic Activities Shaped Phylogeographic Patterns of Extant Orangutans (genus: Pongo). In: Molecular Biology and Evolution. Band 28 (8), 2011, S. 2275–2288
- ↑ Puji Rianti, Dyah Perwitasari-Farajallah, Dondin Sajuthi, Joko Pamungkas, Alexander Nater und Michael Krützen: Identification of Diagnostic Mitochondrial DNA Single Nucleotide Polymorphisms Specific to Sumatran Orangutan (Pongo abelii) Populations. In: HAYATI Journal of Biosciences. Band 22, 2015, S. 149–156
- ↑ a b Alexander Nater, Maja P. Mattle-Greminger, Anton Nurcahyo, Matthew G. Nowak, Marc de Manuel, Tariq Desai, Colin Groves, Marc Pybus, Tugce Bilgin Sonay, Christian Roos, Adriano R. Lameira, Serge A. Wich, James Askew, Marina Davila-Ross, Gabriella Fredriksson, Guillem de Valles, Ferran Casals, Javier Prado-Martinez, Benoit Goossens, Ernst J. Verschoor, Kristin S. Warren, Ian Singleton, David A. Marques, Joko Pamungkas, Dyah Perwitasari-Farajallah, Puji Rianti, Augustine Tuuga, Ivo G. Gut, Marta Gut, Pablo Orozco-terWengel, Carel P. van Schaik, Jaume Bertranpetit, Maria Anisimova, Aylwyn Scally, Tomas Marques-Bonet, Erik Meijaard und Michael Krützen: Morphometric, Behavioral, and Genomic Evidence for a New Orangutan Species. In: Current Biology. 2017, doi:10.1016/j.cub.2017.09.047
- ↑ Terry Harrison, Yingqi Zhang, Liyun Yang, Zengjian Yuan: Evolutionary trend in dental size in fossil orangutans from the Pleistocene of Chongzuo, Guangxi, southern China. Journal of Human Evolution, Volume 161, Dezember 2021, 103090, doi:10.1016/j.jhevol.2021.103090
- ↑ Joseph Milton: Orang-utans join the genome gang: Genetic data might help save ’man of the forest’., Nature, online publiziert 26. Januar 2011, doi:10.1038/news.2011.50.
- ↑ Erik Meijaard, Serge Wich, Marc Ancrenaz, Andrew J. Marshall: Not by science alone: why orangutan conservationists must think outside the box. In: Annals of the New York Academy of Sciences, The Year in Ecology and Conservation Biology, 2011, S. 1–16, doi:10.1111/j.1749-6632.2011.06288.x (PDF)
- ↑ R. Patnaik, P. Chauhan: India at the cross-roads of human evolution. In: Journal of Biosciences. 34, 2009, S. 729–747.
- ↑ J. C. Barry, M. L. E. Morgan, L. J. Flynn, et al.: Faunal and environmental change in the late Miocene Siwaliks of northern Pakistan. In: Paleobiol. Band 28, 2002, S. 1–71.
- ↑ Yasamin Kh. Ibrahim, Lim Tze Tshen, Kira E. Westaway, Earl of Cranbrook, Louise Humphrey, Ros Fatihah Muhammad, Jian-xin Zhao, Lee Chai Peng: First discovery of Pleistocene orangutan (Pongo sp.) fossils in Peninsular Malaysia: Biogeographic and paleoenvironmental implications. In: Journal of Human Evolution Band 65 (6), 2013, S. 770–797 (PDF)
- ↑ H. D. Kahlke: A review of the Pleistocene history of the Orang-Utan (Pongo Lacépède 1799). In: Asian Perspect, Band 15, Nr. 1, 1972, S. 5–15 (PDF).
- ↑ M. E. Steiper: Population history, biogeography, and taxonomy of orangutans (Genus: Pongo) based on a population genetic meta-analysis of multiple loci. In: Journal of Human Evolution. Band 50, 2006, S. 509–522.
- ↑ Natasha Arora, Alexander Nater, Carel P. van Schaik, Erik P. Willems, Maria A. van Noordwijk, Benoit Goossens, Nadja Morf, Meredith Bastian, Cheryl Knottd Helen Morrogh-Bernard, Noko Kuze, Tomoko Kanamori, Joko Pamungkas, Dyah Perwitasari-Farajallah, Ernst Verschoor, Kristin Warren, Michael Krützen: Effects of Pleistocene glaciations and rivers on the population structure of Bornean orangutans (Pongo pygmaeus). In: PNAS, Band 107, 2010, Nr. 50, S. 21376–21381, doi:10.1073/pnas.1010169107.
- ↑ Jan Beck, Cecil M. Rüdlinger: Currently available data on Borneo geometrid moths do not provide evidence for a Pleistocene rainforest refugium. In: Raffles Bulletin of Zoology. Band 62, 2014, S. 822–830.
- ↑ Paulette Dellios: A lexical odyssey from the Malay World. In: Journal of Pidgin and Creole Languages. Band 23, Nr. 1, 2008, S. 461, Volltext (PDF; 141 kB)
- ↑ Brehms Tierleben. Allgemeine Kunde des Tierreichs. Die Säugetiere. (1900), abgerufen am 14. März 2011
- ↑ Colin Groves: A history of gorilla taxonomy. In: Andrea Taylor und Michele Goldsmith (Hrsg.): Gorilla Biology: A Multidisciplinary Perspective. Cambridge University Press 2002, ISBN 0-521-79281-9, PDF ( vom 26. März 2009 im Internet Archive)
- ↑ Andrew Battell: The Strange Adventures of Andrew Battell of Leigh, in Angola and the Adjoining Regions. Hakluyt Society, London 1901 (Nachdruck der wesentlich erweiterten zweiten Auflage, um 1625), S. 54, Volltext
- ↑ Mustafa Haikal: Master Pongo. Ein Gorilla erobert Europa. Transit Buchverlag, Berlin 2013, S. 11, ISBN 978-3-88747-285-6
- ↑ Immanuel Kant: Kants Werke. Akademie-Ausgabe, Band IX, S. 337. De Gruyter 1977. Zitiert aus: Hans Werner Ingensiep: Der kultivierte Affe. Philosophie, Geschichte, Gegenwart. S. Hirzel, Stuttgart 2013, S. 116, ISBN 978-3-7776-2149-4
- ↑ Arthur Schopenhauer: Die Welt als Wille und Vorstellung. Band 2, Kapitel 31, S. 506
- ↑ Jean-Baptiste de Lamarck: Zoologische Philosophie. Verlag Harry Deutsch, Frankfurt am Main 1977 (Reprint), ISBN 3-8171-3409-6, S. 262
- ↑ Video: Werkzeuggebrauch und einsichtiges Handeln eines Orang-Utans, doi:10.3203/IWF/D-1343
- ↑ Video: Planvolles Handeln bei einem Orang-Utan – Puzzle- und Labyrinthversuche, doi:10.3203/IWF/D-1537
- ↑ Zoorangerie – Ein Dschungel für die Orang-Utans. Allwetterzoo Münster, abgerufen am 22. März 2017.
- ↑ Orangutan Language Project ( vom 6. Februar 2012 im Webarchiv archive.today)
- ↑ Badische Woche Nr. 51, 16./17. Dezember 2022, S. 5.
- ↑ K. A. Cawthon Lang KA: Primate Factsheets: Orangutan (Pongo) Conservation Status
- ↑ Stiftung PanEco
- ↑ Sumatra Orang-Utan Schutzprogramm (SOCP)
- ↑ Sumatra Orang-Utan Schutzprogramm: Auswilderung ( vom 13. April 2013 im Internet Archive)
- ↑ Borneo Orang Utan Survival Foundation - BOS (engl./indon.)
- ↑ BOS Deutschland: Rehabilitationsprojekte
- ↑ Semengoh Wildlife Rehabilitation Centre
- ↑ Borneo Orang-Utan-Hilfe ( vom 12. März 2013 im Internet Archive)
- ↑ Bukit Merah Ressort ( vom 19. Februar 2013 im Webarchiv archive.today)
- ↑ WWF: Orang-Utans Facts. Abgerufen am 2. Juni 2019.
- ↑ WWF: Orang-Utans Facts. Abgerufen am 2. Juni 2019.
- ↑ WWF: Orang-Utans Facts. Abgerufen am 2. Juni 2019 (englisch).
- ↑ Sumatra-, Tapanuli- und Borneo-Orang-Utan auf der Roten Liste der IUCN